Химически чистая вода H2O бесцветна, не имеет запаха и вкуса, в относительно толстом слое кажется окрашенной в голубоватый цвет.

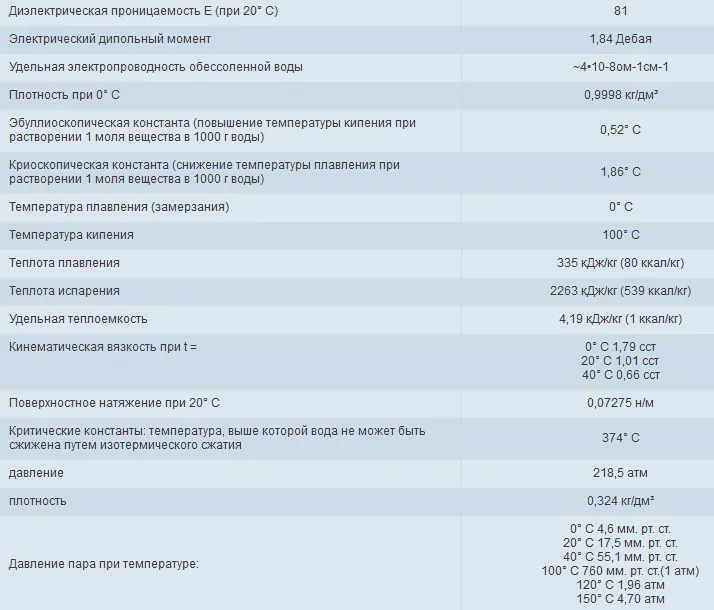
Молекула воды состоит из двух одновалентных ионов водорода H+ и двухвалентного ионы кислорода О2—, которые расположены в вершинах равнобедренного треугольника. Угол у вершины треугольника, занятый ионом кислорода, равен 104,5°, длина связи О—Н равна 0,096 нм, расстояние между ионами Н+ равно 0,15 нм, размер молекулы воды считается близким к 0,28 нм (рис. 1.1).
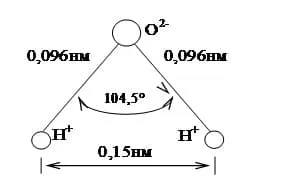
Рис. 1.1. Простейшая схема молекулы воды
Ближе к реальности представление молекулы H2O в форме пространственной фигуры — тетраэдра с двумя положительными вершинами на ионах водорода Н+ и двумя отрицательными вершинами на вытянутых электронных орбитах иона кислорода (рис. 1.2). Иногда упрощенно молекулы воды изображают в виде диполя (рис. 1.3), поскольку центры положительных и отрицательных зарядов не совпадают.
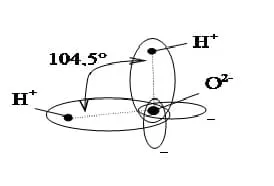
Рис. 1.2. Представление молекулы воды в виде тетраэдра Рис. 1.3. Представление молекулы воды в виде диполя
Особенностью молекул воды являются способность соединяться между собой в многозвенные ассоциаты за счет образования водородных связей (рис. 1.4).
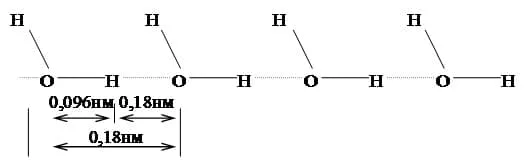
Рис. 1.4. Схема образования водородных связей между молекулами воды
Поскольку у молекулы имеются как бы четыре полюса электрических зарядов, то каждая молекула связывается с четырьмя другими молекулами, располагающимися также в вершинах тетраэдра (рис. 1.5).
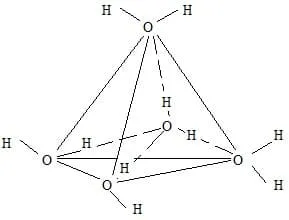
Рис. 1.5. Пространственный ассоциат в виде тетраэдра из молекул воды
Степень ассоциированности зависит от температуры воды. Полностью все молекулы ассоциированы между собой в единую жесткую пространственную структуру только во льду, причем при температуре ниже —183° С. При более высокой температуре часть водородных связей разрушается; считается, что вблизи температуры плавления (0° С) разрушаются 9–16% общего количества водородных связей, а при 40° С — примерно половина. При переходе в газообразное состояние (в пар) разрушаются практически все водородные связи, очень небольшая часть молекул воды соединена в двойные агрегаты (дигидроли). Изменение степени ассоциированности оказывает столь заметное влияние на свойства воды, что, по мнению некоторых специалистов, воду при 25—75°С и воду вблизи 0°С можно рассматривать как два различных по своей природе растворителя. Жидкую воду можно представить состоящей из областей двух видов — «льдоподобных» с ассоциированными молекулами и «плотноупакованных» со свободными отдельными молекулами. Такие области, включающие 102–103 молекул, постоянно разрушаются и вновь возникают.
Энергия водородных связей составляет около 18,9 кДж/моль (4,5 ккал/моль), она значительно меньше энергии химической связи, составляющей более 100 кДж/моль. В то же время эта энергия превышает энергию вандервальсовых сил (9,6 кДж/моль) и энергию теплового движения молекул (около 2,5 кДж/моль при 27° С). Энергия образования молекул воды из водорода и кислорода представляет собой достаточно большую величину — 242 кДж/моль, что обусловливает высокую устойчивость молекул. Вода не изменяется под действием большинства соединений, которые растворяет, и считается инертным растворителем.
Вода имеет большую диэлектрическую проницаемость, кроме того ее молекулы представляют собой диполи, поэтому обладает высокой растворяющей способностью по отношению к полярным соединениям из-за снижения межатомных и межмолекулярных сил. Ионы растворенных веществ размещаются в структуре воды или в ее полостях, либо замещая молекулы Н2О. В любом случае они вызывают изменение структуры воды: во-первых, из-за несовпадения размеров иона и молекулы H2O, во-вторых, из-за изменения ориентации молекул Н2О вследствие влияния иона. Крупные слабозаряженные ионы разрушают структуру воды. Небольшие высокозаряженные ионы способствуют структурообразованию в воде, правда, эти структуры могут отличаться от характерной для воды льдоподобной структуры. Однако все эти эффекты справедливы до температуры 40—50°С, при более высокой температуре все ионы способствуют упрочнению структуры воды.
Эффект разрушения — упрочнения структуры сказывается на таких параметрах, как вязкость, диффузия и, соответственно, зависящих от них явлений очистки воды (коагуляция, осаждение и т.д.)
Образование структур из дипольных молекул воды вокруг ионов растворимых веществ или других заряженных частиц носит название гидратации. Чем выше заряд иона и чем меньше его размеры, тем сильнее он гидратируется, тем большее количество молекул воды входит в гидратную оболочку иона. Катионы, как правило, гидратируются сильнее, чем анионы.